Un reactor químico es un equipo en cuyo interior tiene lugar una reacción química, estando éste diseñado para maximizar la conversión y selectividad de la misma con el menor coste posible.
8.1 Reactor discontinuo.
Son aquellos que trabajan por cargas, es decir se introduce una alimentación, y se espera un tiempo dado, que viene determinado por la cinética de la reacción, tras el cual se saca el producto.
Problema.
En un reactor discontinuo que opera a volumen isostéricamente se alcanza un 70% de conversión del reactivo líquido en 13 min. ¿Qué tiempo espacial se requiere para efectuar esta operación en un reactor de flujo en pistón y uno de mezcla completa?
Solución
Porque el sistema es de densidad constante (líquido).
Por lo tanto,
PFR
Estos reactores trabajan en estado estacionario. Es decir, las propiedades en un punto determinado del reactor son constantes con el tiempo. Este modelo supone un flujo ideal de pistón, y la conversión es función de la posición.
Problema:
Un compuesto orgánico experimenta una pirolisis al hacerlo circular
a través de un rfp consistente en un tubo cilíndrico que atraviesa el interior
de un horno. Se desea desarrollar la reacción endotérmica a temperatura constante
e igual a 675 °C. Se sabe que su cinética es de primer orden y que la constante de
velocidad, expresada en s-1, varía con la temperatura según la expresión:
lnk= 34.34- 34000/T
La temperatura del aire que rodea al tubo coincide prácticamente con la de las
paredes del horno y es de 1000 °C. El coeficiente global de transmisión de calor
por convección y radiación desde el horno al interior del tubo vale 34 J/s·m2
·K. En
estas condiciones la cantidad de calor que recibe la mezcla de reacción por unidad
de tiempo es 2.11·106
kJ/h para obtener un grado de conversión de 0.3.
¿Cuáles serán las dimensiones del tubo de reacción si el caudal volumétrico del
alimento es 4.245 m3
/s?
Solución:
Balance de materia:
Ecuación cinética:
Solución:
Balance de materia:
Balance de energía del reactor:
Balance de energía del intercambiador:
Esquema:
A1= A2
Ecuación cinética:
T0= 675°C= 948 K cte.
Qv0= 4.245 m^3/ S
X= 0.3
L= ?
Solución
V= Volumen del reactor.
FA0= Flujo molar del reactivo limitante.
Tao= Tiempo espacial.
CA0= Concentración inicial del reactivo A.
XA= Conversión de A
rA= velocidad de reacción de A.
Qv0= 4.245 m^3/ S
X= 0.3
L= ?
L= 32.16 m.
CSTR
Es un tanque en el cual la masa reaccionante es continuamente agitada de
tal manera que se considera como una mezcla completa y, por lo tanto, se asume que sus
propiedades son uniformes en todo el interior del reactor.
Problema
Escribe la ecuación de diseño de un reactor de mezcla completa y escribe que significa cada variable.Solución
V= Volumen del reactor.
FA0= Flujo molar del reactivo limitante.
Tao= Tiempo espacial.
CA0= Concentración inicial del reactivo A.
XA= Conversión de A
rA= velocidad de reacción de A.
Problema
La reacción que estudiaremos es la de la obtención de propilenglicol a partir de óxido de propileno y agua, cuya estequiometría es:
La reacción es de primer orden con respecto a la concentración de óxido de propileno y el factor preexponencial de la reacción es: 1.7x10^13.
a) Escribe la ecuación cinética.
b) Expresa la constante de velocidad.
Solución:
a) Como nos dice que es de primer orden respecto al óxido de propileno:
b) Utilizando la ecuación de Arrhenius:
Al final se liberan los productos:
La reacción que estudiaremos es la de la obtención de propilenglicol a partir de óxido de propileno y agua, cuya estequiometría es:
La reacción es de primer orden con respecto a la concentración de óxido de propileno y el factor preexponencial de la reacción es: 1.7x10^13.
a) Escribe la ecuación cinética.
b) Expresa la constante de velocidad.
Solución:
a) Como nos dice que es de primer orden respecto al óxido de propileno:
b) Utilizando la ecuación de Arrhenius:
Proyecto de integración:
Etapa 1
1.
Catálisis:
Es un proceso
en el cual aumenta o disminuye la velocidad de una reacción química debido a la
participación de una sustancia llamada catalizador que no es modificado por la
reacción.
2.
Catalizador:
Es una
sustancia que altera la velocidad de una reacción química sin aparecer en el
producto final.
¿Cómo
funciona una enzima como catalizador?
Supongamos que esta figura es el sustrato:
Y esta otra figura es la enzima:
El sustrato se una a la enzima:
El enzima cambia de forma y se lleva a cabo la reacción:
Al final se liberan los productos:
Etapa 2
El objetivo de esta segunda etapa es elegir un proyecto en el que podamos comprobar experimentalmente la acción de las enzimas en una reacción química.
Selección del instrumento.
Elegiremos medir la manera en la que se degrada una
cantidad de alimento después de agregar una solución enzimática. Investigamos
que las proteasas son enzimas que aceleran la degradación de proteínas. Son
utilizados comúnmente por fabricantes de detergentes para lavar ropa para
remover manchas derivadas de proteína como huevo, sangre, etc.
Dado que los materiales son fáciles de conseguir decidimos
seleccionar esta opción.
Selecciona y define el recurso o instrumento a
desarrollar y/o implementar.
Para probar la acción de enzimas en este caso solo
necesitaremos tubos de ensayo, el alimento que contendrá proteína y la solución
enzimática que será el detergente. Consistirá en colocar la gelatina
solidificada en dos tubos de ensayo y marcaremos la altura de la gelatina con
un marcador. A un tubo le agregaremos la solución enzimática y al otro le
agregaremos agua de manera que después de un tiempo podamos comparar la
degradación de la proteína que está en la gelatina.
Diseño del experimento.
Objetivo:
·
Probar la reacción de
enzimas sobre una reacción.
·
Comprobar que las
proteasas degradan las proteínas.
·
Conocer casos concretos
de aplicación de productos de uso cotidiano.
Hipótesis:
Dada la investigación que realizamos conocemos que las
proteasas degradan las proteínas. Sabemos que la gelatina contiene cadenas
proteicas. Por lo que nuestra hipótesis es que el tubo de ensayo al que se le
agregue la solución de detergente degradará a un nivel mayor la gelatina.
Mientras que al tubo al que se le agregue agua solo diluirá la gelatina.
Variables:
En
nuestro proceso lo que va a variar será el nivel de la gelatina en nuestro tubo
de ensayo y dependerá del tipo de solvente que se le agregará. En el caso de la
solución enzimática (solución acuosa de detergente) la degradación de la
gelatina también dependerá de la concentración de ésta.
Establecer los tratamientos:
Utilizaremos gelatina dado que está compuesta por cadenas
proteicas que pueden ser fácilmente degradadas en sus aminoácidos componentes. Usaremos
18 g de gelatina por cada 50 ml. de agua. Usaremos dos tubos de ensayo y los
llenaremos con 10 ml. de la solución de gelatina preparada, posteriormente la
enfriaremos hasta que se solidifique. A continuación marcaremos la altura a la
que llega la gelatina con un marcador en el tubo de ensayo.
Prepararemos una solución de detergente al 10% en volumen.
A uno de los tubos de ensayo le agregaremos 30 gotas de esta solución. Al otro
le agregaremos 30 gotas de agua de manera que podamos comparar el efecto que
tengan.
Revisaremos los tubos de ensayo después de 24 horas y
marcaremos la posición de la gelatina sólida, luego lo volveremos a revisar
después de 48 horas.
Repeticiones y muestras:
El
experimento lo realizaremos por triplicado. Para cada repetición se usarán dos
tubos de ensayo a uno se le agregará agua y al segundo la solución enzimática.
Al final compararemos que tanto se degradará la gelatina con cada uno de estos
solventes.
Interpretación
y conclusiones:
Una vez que obtengamos los resultados determinaremos cuál
de los dos solventes degradó en mayor nivel la gelatina. Si nuestra hipótesis
se cumple la solución de detergente la degradará de manera más efectiva. Y así
podremos comprobar la acción que tienen las proteasas sobre las proteínas.
Etapa 3
Objetivo
General
Probar el efecto que
tienen las enzimas al actuar sobre un sustrato con una reacción, y corroborar
experimentalmente que las proteasas son enzimas que degradan las proteínas.
Específicos
-
Probar la reacción de enzimas
sobre una reacción.
-
Comprobar que las proteasas
degradan las proteínas.
-
Conocer casos concretos de
aplicación de productos de uso cotidiano.
Hipótesis
La gelatina se degradara al agregarle la
solución enzimática, debido a su composición de cadenas de proteínas.
Fundamentos
Los Enzimas como aplicación en la industria de
los detergentes, son altamente específicas y los procesos que utilizan enzimas
generalmente generan menos reacciones secundarias y subproductos que los otros
procesos químicos, y además son más respetuosos del medio ambiente. Las enzimas
también permiten que algunos procesos, que de otro modo no serían prácticos, se
puedan llevar a cabo de una manera eficiente.
En sí, los enzimas son proteínas que catalizan
reacciones químicas en los seres vivos. Los enzimas son catalizadores, es
decir, sustancias que, sin consumirse en una reacción, aumentan notablemente su
velocidad. Tienen una enorme
variedad de funciones dentro de la célula: degradan azúcares, sintetizan grasas
y aminoácidos, copian fielmente la información genética, participan en el
reconocimiento y transmisión de señales del exterior y se encargan de degradar
subproductos tóxicos para la célula, entre muchas otras funciones vitales. La
identidad y el estado fisiológico de un ser vivo está determinado por la
colección de enzimas que estén funcionando con precisión de cirujano y con la
velocidad de un rayo en un momento dado dentro de las células. Así, a lo largo
de millones de años de evolución, la naturaleza ha desarrollado una gran
diversidad de enzimas para mantener el complejo fenómeno de la vida.
Por
otro lado, las proteínas son nutrientes de gran importancia biológica, son
macromoléculas que constituyen el principal nutriente para la formación de los
músculos del cuerpo.
Una de la funciones de las proteínas consiste
en transportar las sustancias grasas a través de la sangre, elevando así las
defensas de nuestro organismo. Por lo tanto la ingesta diaria de
estos nutrientes que son las proteínas es imprescindible para una
dieta sana y saludable para todos siendo la ingesta de alimentos ricos en proteínas de
especial importancia en la nutrición deportiva.
Las proteasas son enzimas que aceleran la
degradación de proteínas. Comúnmente son usadas por muchos fabricantes de
detergentes para ropa, quienes las agregan a las formulaciones para remover
manchas derivadas de proteínas, tales como huevo, sangre, etc. Muchas de estas
proteasas son derivadas de cepas bacterianas de Bacillus sp. Las proteasas
bacterianas son extremadamente estables a pH alcalinos, largos períodos de
almacenamiento y temperaturas variables. Estas bacterias también han sido
modificadas por ingeniería genética para aumentar la capacidad de las proteasas
que ellas producen, ante la presencia de blanqueadores que de otro modo podrían
afectarlas. La gelatina está compuesta por cadenas proteicas que son fácilmente
degradadas en sus aminoácidos componentes. Se prepara del colágeno, una
proteína presente en tendones y piel de animales.
Materiales y Reactivos
-
4 tubos de ensayo
-
Varilla de vidrio
-
Pipeta Volumétrica 5ml
-
Pipeta Volumétrica 2ml
-
Pipeta Volumétrica 1ml
-
Plancha de calefacción
-
Vaso de Precipitado de precipitado
100 ml
-
Gelatina en polvo
-
Detergente en polvo
-
Agua destilada
Procedimiento
- Preparar la gelatina, calentar 50ml ce
agua destilada, pesar 18 gr de gelatina.
- Diluir la gelatina en agua caliente.
- Colocar 9ml de gelatina liquida en los 4
tubos de ensayo.
- Refrigerar la gelatina para que
solidifique.
- Marcar los tubos hasta la marca de
gelatina.
- Preparar
una disolución con el detergente en polvo, 10% en volumen.
Se realizó el experimento a 2 temperaturas de
22°C y 16°C, en ambos casos se realizo el mismo procedimiento. El de 16°C se
realizó en un baño de gel. El tubo con agua cumple la función del blanco.
- A un tubo de ensayo se le agregan 30 gotas
de agua destilada.
- Al
otro tubo de ensayo de le agregan 30 gotas de la solución enzimática.
Se monitorearon las
primeras 3 horas, y las posteriores al transcurrir 16, 17 y 18 horas
respectivamente.
Resultados
Se usó un peso molecular promedio del colágeno dado que es una proteína.
Se colocaron 6 ml. en
cada tubo de ensayo, con la molaridad calculamos la concentración inicial de la
gelatina.
Se realizan los
registros del volumen de gelatina que va disminuyendo con el paso del tiempo.
Usando la molaridad se transforma de volumen a moles consumidas, con la
relación entre la diferencia de volumen y las moles consumidas se encuentra la
concentración transformada de gelatina, la concentración final y el porcentaje
de conversión.
Se usa el Δt para
calcular la rapidez dividiendo la concentración inicial menos la total entre la
diferencia de temperatura.
Cf-C0/ Δt
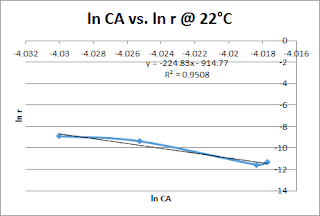
Graficamos el logaritmo
natural de la concentración final contra el logaritmo natural de la
rapidez.
Es importante mencionar que solo se graficaron
los últimos cuatro datos, dado que había un salto de tiempo muy grande en la
recolección de resultados esto provocaba una gran desviación y que los
resultados no fueran lineales.
Se repitió el mismo proceso de cálculo para una
temperatura de 16°C.
Análisis de Resultados
La hipótesis de la práctica era que la gelatina
se degradaría al agregarle la solución enzimática creada con el detergente, esto
debido a la composición de cadenas de proteínas de la gelatina, las cuales se
desharían con los enzimas. Al realizar la práctica observamos como conforme
pasaba el tiempo la gelatina se degradaba lentamente, influyo la temperatura a
la cual se llevó a cabo cada muestra, pudimos observar que a 22°C el volumen de
degradación era mayor que el de 16°C. Podemos observar que a 22°C la pendiente
de la gráfica de ln CA contra ln r es mucho más pronunciada que la de 16°C lo
cual nos lleva a esa conclusión.


























Comentarios
Publicar un comentario