4.1 Ecuación de Arrhenius.
La dependencia de k con respecto a la temperatura puede expresarse mediante la ecuación de Arrhenius:
Su forma linealizada es:
Otra forma de trabajar con la ecuación de Arrhenius es:
Problema.
Para la descomposición del N2O5, la energía de activación es 24.7 kcal/mol. A 27ºC
la constante de velocidad de la reacción es 4.0 10-5 s
-1. Calcular la constante de
velocidad a 37ºC.
Solución.
Problema.
¿Qué ocurrirá si aumentamos la temperatura según la ecuación de Arrhenius?
Solución.
Si se aumenta la temperatura aumenta
el valor de k.
Dada nuestra ecuación de velocidad de reacción:
Por lo tanto, según Arrhenius un aumento en la temperatura significa un aumento en velocidad de reacción.
4.2 Energía de activación.
Es la energía mínima necesaria para que se produzca una reacción química dada.
Problema.
Para la reacción aA+bB= Productos. Calcule la energía de activación, sabiendo que la constante de velocidad se multiplica por 74 cuando la temperatura a la que se realiza pasa de 300K a 400K.
Sustituimos los datos que nos proporciona el problema y obtenemos la energía de activación:
Problema.
Para la descomposición del N2O5 se ha medido la constante de velocidad a 25°C y 55°C,
encontrándose valores de 3.46·10^-5 y 1.5·10^-3 s^-1, respectivamente. Determina la energía
de activación y la constante de velocidad a una temperatura de 0°C.
Solución:
Sustituyendo y tomando en cuenta que las temperaturas debemos expresarlas en K.
Para obtener el valor de k a 0°C, sustituímos el valor que obtuvimos de k en la expresión que relaciona las constantes.



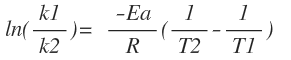








Comentarios
Publicar un comentario